सोडियम हाइपोक्लोराइट सूत्र जिसे तरल ब्लीच सूत्र या एंटीफोमिंन के रूप में जाना जाता है। इस आयनिक यौगिक में एक धनायन, सोडियम धातु (Na + ) होता है जो कि आयनों, हाइपोक्लोराइट (ClO - ) से जुड़ा होता है । सोडियम हाइपोक्लोराइट का रासायनिक या आणविक सूत्र NaClO है।
यह थोड़ा पीले पानी के तरल रंग के लिए बेरंग है जिसमें घरेलू ब्लीच की गंध है। यह पानी में घुल जाता है। इस यौगिक का निर्माण फ्रांस के क्लाउड लुइस बर्थोलोलेट द्वारा वर्ष 1789 में किया गया था। इस यौगिक को पोटाश लाई घोल के माध्यम से क्लोरीन गैस पास करके प्राप्त किया गया था। अप्रत्यक्ष रूप से इसे हुकर प्रक्रिया द्वारा संश्लेषित किया जा सकता है। इस प्रक्रिया में सोडियम हाइड्रॉक्साइड को क्लोरीन गैस के साथ प्रतिक्रिया करने के लिए, NaClO प्लस सोडियम क्लोराइड और पानी उत्पन्न करने के लिए बनाया जाता है।
सोडियम हाइपोक्लोराइट के सूत्र और संरचना
सोडियम हाइपोक्लोराइट का रासायनिक सूत्र NaClO है, और इसका दाढ़ द्रव्यमान 74.44 ग्राम / मोल है।
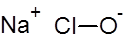
यह हाइपोक्लोराइट अयन (ClO - ) से बंधित सोडियम धातु केशन (Na + ) से बना एक आयनिक यौगिक है ।
सोडियम हाइपोक्लोराइट फॉर्मूला के गुण
| सोडियम हाइपोक्लोराइट का रासायनिक सूत्र | NaClO |
| सोडियम हाइपोक्लोराइट का आणविक भार | 74.442 ग्राम / मोल |
| सोडियम हाइपोक्लोराइट का घनत्व | 1.11 ग्राम / सेमी 3 |
| सोडियम हाइपोक्लोराइट का क्वथनांक | 101 ° से |
| सोडियम हाइपोक्लोराइट का गलनांक | 18 ° से |
उच्च सांद्रता में, यह संक्षारक और विषाक्त है। जब इस यौगिक को साँस लिया जाता है तो इससे गंभीर खाँसी, सांस की तकलीफ, जलन और गले में खराश होती है। जब यह यौगिक त्वचा के संपर्क में आता है तो यह त्वचा में जलन, लालिमा और फफोले की ओर जाता है।
सोडियम हाइपोक्लोराइट के भौतिक गुण
शुद्ध अवस्था में, यह 1.11 ग्राम / एमएल, 18 डिग्री सेल्सियस के पिघलने बिंदु और 101 डिग्री सेल्सियस के क्वथनांक के घनत्व के साथ एक अस्थिर प्रकाश हरे ठोस के रूप में मौजूद है। यह आमतौर पर एक जलीय पीला हरा या पीले रंग के घोल के रूप में पाया जाता है। जलीय NaClO समाधान कई अलग-अलग सांद्रता या शक्ति (1% से 25% तक) में उपलब्ध हैं, जो इसके अंतिम उपयोगों पर निर्भर करता है।
सोडियम हाइपोक्लोराइट के रासायनिक गुण
सोडियम हाइपोक्लोराइट एक अच्छा ऑक्सीकरण एजेंट है। यह जहरीले क्लोरीन गैस को मुक्त करते हुए लवण बनाने के लिए एचसीएल जैसे प्रोटिक एसिड के साथ प्रतिक्रिया करता है। यह हाइपोक्लोरस एसिड (HClO) बनाने के लिए कुछ एसिड के साथ प्रतिक्रिया भी करता है। पानी में, यह सोडियम और क्लोराइड आयनों के साथ-साथ शक्तिशाली ऑक्सीकरण एजेंट, हाइड्रॉक्सिल कट्टरपंथी (ओएच । ) में विघटित हो जाता है । NaClO सोडियम क्लोराइड और ऑक्सीजन में भी विघटित हो जाता है।
NaClO उपयोग (सोडियम हाइपोक्लोराइट)
इसका उपयोग कपड़े धोने वाले ब्लीच में एक प्रमुख घटक के रूप में किया जाता है।
इसका उपयोग ब्लीचिंग एजेंट के रूप में किया जाता है।इसका उपयोग कपड़ा उद्योगों में किया जाता है। इसका उपयोग ऑक्सीकरण एजेंट के रूप में किया जाता है।
इसका उपयोग डिटर्जेंट उद्योगों में किया जाता है। इसका उपयोग पेट्रोलियम उत्पादों के शोधन में किया जाता है।
इसका उपयोग कागज उद्योगों में किया जाता है। इसका उपयोग अपशिष्ट उपचार में किया जाता है।
इसका उपयोग कीटाणुनाशक के रूप में किया जाता है। इसका उपयोग खाद्य प्रसंस्करण में खाद्य तैयारी उपकरण को साफ करने के लिए किया जाता है।
इसका उपयोग स्विमिंग पूल में संक्रामक एजेंटों को खाड़ी में रखने के लिए किया जाता है।
सोडियम हाइपोक्लोराइट के सुरक्षा और खतरे
सोडियम हाइपोक्लोराइट उच्च सांद्रता में एक विषाक्त और संक्षारक यौगिक है। जब निगल लिया जाता है, तो यह बहुत विषाक्त हो सकता है। यह कुछ एसिड के साथ-साथ अमोनिया के साथ क्लोरीन जैसी जहरीली गैसों का उत्पादन करने के लिए भी प्रतिक्रिया करता है, जिससे आंखों में जलन और सांस की समस्या हो सकती है। ब्लीच के मजबूत समाधान भी त्वचा की जलन का कारण बन सकते हैं।
टिप्पणियाँ